), мы рассмотрим такие важные для организации и проведения клинических исследований процедуры, как рандомизация и раскрытие кода.
Термин «рандомизация » произошел от англ. слова random (сделанный или выбранный наугад, беспорядочный) и в контексте клинических исследований обозначает случайный характер процесса распределения испытуемых в основную(-ые) и контрольную(-ые) группы . Применение процедуры рандомизации обеспечивает более надежную статистическую основу количественной оценки различий между исследуемым(-и) препаратом(-ами) и контролем, способствует более равномерному распределению прогностических факторов (известных и неизвестных). В комбинации с процедурой ослепления рандомизация позволяет свести к минимуму систематическую ошибку (неслучайное, однонаправленное отклонение результатов исследования от истинных значений), связанную с распределением испытуемых по группам лечения (так как обеспечивает невозможность предвзятого распределения) . Поэтому рандомизированные исследования считаются более доказательными и информативными, чем те, в которых отсутствует процедура рандомизации, а золотым стандартом доказательности (класс I) являются рандомизированные двойные слепые контролируемые исследования. Процедура рандомизации в каждом конкретном клиническом исследовании заранее закрепляется протоколом, должна неукоснительно выполняться, а все отклонения от нее должны быть включены в отчет об исследовании (как факторы, влияющие на окончательный вывод) .
Основные обязанности ответственного исследователя и уполномоченных соисследователей, связанные с рандомизацией, указаны в соответствующем пункте ICH GCP :
4.7. Исследователь должен придерживаться методики рандомизации в ходе исследования, если таковая предусмотрена, и обеспечивать, чтобы раскрытие кода происходило только в соответствии с протоколом. Если исследование проводится слепым методом, исследователь должен немедленно зарегистрировать и объяснить спонсору какое-либо преждевременное раскрытие кода исследуемого(-ых) препарата(-ов) (например, случайное раскрытие кода или раскрытие кода в связи с серьезным побочным явлением).
Основной целью введения этих требований (как и самой рандомизации) является борьба с системной ошибкой на уровне исследователя. Очевидно, что процедура рандомизации, описанная в протоколе, должна неукоснительно выполняться, как и все другие процедуры. Поскольку при нарушении процедуры рандомизации на одной клинической базе под сомнение могут быть поставлены результаты всего исследования, сложно переоценить важность следования прописанным инструкциям для каждого конкретного исследователя. Как известно, любые действия в ходе клинического исследования необходимо тщательно документировать. Преждевременное раскрытие рандомизационного кода при слепом исследовании (то есть получение информации о том, какое именно лечение получает конкретный испытуемый) является событием, влияющим на сбор и оценку данных, поэтому исследователь обязан немедленно известить спонсора (или его представителей), предоставить ему исчерпывающие объяснения, а затем следовать полученным инструкциям. Если раскрытие кода произошло в связи с невыполнением оговоренных процедур одним из соисследователей, ответственный исследователь должен провести дополнительное обучение персонала (и задокументировать этот факт в файле исследования) для предотвращения повторения подобной ситуации.
Вопрос-ответ
Какие существуют типы рандомизации? В чем их преимущества и недостатки?
Выделяют фиксированную рандомизацию (простую, блоковую и стратифицированную), динамическое распределение (метод «несимметричной монеты» и адаптивную рандомизацию). При фиксированной рандомизации пациент распределяется в ту или иную группу на основании случайных чисел, полученных из специальных таблиц или сгенерированных с помощью компьютерной программы. Простая рандомизация предполагает равновероятное распределение испытуемых в группы. Так, в случае, если имеются две группы - основная и контрольная, то есть вероятность попадания в группу лечения равна вероятности попадания в группу контроля и равна 50%. В таком случае возможно возникновение на определенном этапе исследования существенной разницы в численности групп, дисбаланса групп по возрасту, полу, тяжести заболевания и другим признакам. Метод блоковой рандомизации помогает достичь большей сбалансированности между группами по численности испытуемых в каждый момент проведения исследования - рандомизационная последовательность в этом случае формируется из блоков заданной длины, внутри которых и проводится случайное распределение .
Пример готовой рандомизационной последовательности при блоковой рандомизации 16 испытуемых (размер блока фиксирован) приведен на рисунке. «А» означает распределение в группу А, «Б» - в группу Б, длина блока 4, вероятность распределения в ту или иную группу в соответствии с протоколом равна 50%. В этом примере первый рандомизированный пациент будет распределен в группу А, второй и третий в группу Б и так далее до 16 пациента, который попадает в группу А. Исследователь не имеет доступа к рандомизационной последовательности и не знает, в какую группу попадет каждый следующий испытуемый.
Однако при блоковой рандомизации исследователь может спрогнозировать, в какую группу будет распределен следующий испытуемый (если известен размер блока, предыдущие распределения внутри блока, а одна из двух групп внутри блока полностью укомплектована) - например, очевидно, что пациенты 7 и 8 из рисунка будут распределены в группу А, если известно, что длина блока 4, а пациенты 5 и 6 были распределены в группу Б. С целью недопущения такой возможности можно использовать случайное определение размера блоков (с использованием генератора случайных чисел) или не раскрывать информацию о величине блока, если она фиксирована.
ВАЖНО!
Хотя в протоколе клинического исследования описывается принцип рандомизации, вероятность попадания в ту или иную группу, используемый технический метод осуществления процедуры, протокол не должен содержать специфических деталей, позволяющих исследователю спрогнозировать результат рандомизации для определенного испытуемого (например, длину блоков при блоковой рандомизации). Это требование содержится в документе ICH E9 .
При стратифицированной (послойной) рандомизации учитывается какой-либо один или несколько (обычно не больше двух) важных признаков, которые могут существенно повлиять на результаты лечения, а, следовательно, должны быть равномерно распределены между группами. Такими признаками могут быть пол, возраст, основной диагноз, основной препарат базовой (неисследуемой) терапии, тяжесть состояния при поступлении и т.д. Это делается для того, чтобы формируемые таким образом отдельные выборки (группы лечения) были репрезентативными по отношению к генеральной совокупности (всех испытуемых, включенных в клиническое исследование) по основным прогностическим факторам, другими словами, чтобы каждая группа лечения была максимально похожа по составу на общую популяцию испытуемых данного исследования .
Метод «несимметричной монеты» позволят достичь большего равновесия между группами по какому-либо одному показателю путем динамического изменения вероятности включения испытуемых в ту или иную группу в зависимости от текущего баланса групп по заданному показателю. Так, для достижения текущего баланса групп по количеству испытуемых применяется следующий алгоритм: при включении испытуемого в исследование вероятность отнесения его к группе с меньшим количеством участников будет больше 50% (как правило, используется вероятность 66,6%), а если численность групп на определенном этапе равна, то вероятность распределения в одну их двух групп для следующего испытуемого составляет 50%.
Методы адаптивной рандомизации применяют при адаптивном дизайне клинических исследований, в которых распределение испытуемых в группы проводится таким образом, чтобы к концу исследования наибольшее количество испытуемых получило наиболее эффективный (или наиболее безопасный) препарат или дозу исследуемого препарата .
В таких случаях вероятность распределения пациентов в ту или иную группу лечения динамически изменяется на основании результатов промежуточных анализов данных. Существует много методов отклик-адаптивной рандомизации - например метод «игра на победителя» (Randomized-Play-the-Winner), пользосмещенная модель (Utility-Offset Model), модель максимальной полезности (Maximum Utility Model).
Преимуществом метода «игра на победителя» является то, что большему количеству пациентов будет назначено более эффективное лечение. К числу недостатков этого метода относится сложность расчета размера выборки; необходимость того, чтобы исходы для каждого предыдущего испытуемого были определены до момента включения следующего испытуемого в исследование; периодическое или постоянное раскрытие данных при слепых клинических испытаниях. Для борьбы с этими недостатками применяют автоматизацию процесса отнесения пациентов в группы путем разработки программного обеспечения и поэтапное проведение исследования.
При использовании в качестве метода адаптивной рандомизации пользосмещенной модели вероятность распределения пациента в ту или иную группу вычисляется на основании частоты положительного отклика на каждый из вариантов лечения и доли испытуемых, уже распределенных в эту группу.
В случае осуществления адаптивной рандомизации с помощью модели максимальной полезности следующий пациент всегда распределяется в ту группу, в которой наблюдается (или на основании модели предполагается) более высокая эффективность лечения.
Однако существуют определенные трудности и особенности применения методов адаптивной рандомизации. При слепом дизайне необходимо, например, обеспечить периодическое или постоянное раскрытие данных (часто для этого привлекается отдельная группа «неослепленных» статистиков); скорость анализа данных зависит от скорости их поступления, поэтому рандомизация следующего пациента может происходить до учета реакции предыдущего испытуемого и т.д.
Вопрос-ответ
Каковы основные практические способы осуществления рандомизации в клинических исследованиях?
Рандомизация может осуществляться непосредственно на клинической базе или централизованно. В первом случае часто используют метод конвертов. При этом спонсор (отдел статистики или подрядчик, отвечающий за процедуру рандомизации) обеспечивает исследователя серией пронумерованных и запечатанных конвертов, в каждом из которых указан один из сравниваемых видов лечения. При включении пациента в исследование врач-исследователь по предусмотренной протоколом процедуре присваивает пациенту один из таких конвертов и, не раскрывая его (при двойном слепом дизайне), выдает исследуемый препарат, соответствующий номеру конверта. В случае острой необходимости (например угрожающее жизни серьезное побочное явление) исследователь имеет возможность распечатать соответствующий конверт и узнать, какой именно препарат получал испытуемый.
ВАЖНО!
При случайном или преднамеренном раскрытии рандомизационного кода исследователь обязан незамедлительно сообщить об этом спонсору, письменно изложить суть и причину такого решения/происшествия .
В качестве преимущества метода конвертов следует отметить относительную автономность исследователя при рандомизации пациента, которая исключает зависимость от технического состояния линий связи. Однако эта же автономность является и недостатком - количество потенциальных рандомизированных испытуемых ограничено количеством доступных конвертов, исследователь должен обеспечить надежное хранение конвертов для исключения доступа к ним посторонних лиц, спонсор должен регулярно контролировать режим хранения и состояние конвертов.
В последнее время получила широкое распространение централизованная рандомизация каким-либо методом. В этом случае для распределения испытуемого в какую-либо группу лечения врач-исследователь сообщает (по телефону, факсу или с помощью интернета) идентифицирующую и значимую информацию о нем (обычно инициалы и возраст/год рождения относятся к идентифицирующей информации; значимая информация зависит от применяемой стратификации - например, основной диагноз или тяжесть состояния по соответствующей шкале) в отдел, отвечающий за процедуру рандомизации. В ответ исследователь получает сообщение о группе лечения или номере упаковки препарата (при двойном ослеплении исследования) для данного больного, во избежание ошибок устная информация дублируется сообщением по факсу или электронным письмом. При необходимости раскрытия кода исследователь обращается с запросом в отдел, проводящий рандомизацию, в соответствии с полученными до начала исследования инструкциями. Часто для осуществления централизованной рандомизации используются полностью автоматизированные системы телефонной связи - интерактивные системы голосового ответа (Interactive Voise Response System - IVRS) или связи по сети Интернет - интерактивные системы веб-ответа (Interactive Web Response System - IWRS). В качестве преимущества централизованных методов рандомизации следует указать более высокую защиту от несанкционированного доступа, быстрое поступление информации о новых пациентах в базу данных исследования, условную неограниченность числа потенциальных рандомизированных в исследовательском центре, более упорядоченную процедуру раскрытия кода. Недостатком можно назвать зависимость от технического состояния средств связи и оборудования.
ВАЖНО!
Обычно при использовании систем IVRS и IWRS каждому уполномоченному члену исследовательской команды присваивается свой уникальный код доступа в систему. Этот код необходимо держать в секрете и не делиться им со своими коллегами. Если ваш коллега по команде исследователей забыл свой конверт дома и просит помочь, вы можете провести процедуру рандомизации сами, но ни в коем случае не сообщайте ему свой код доступа. Это важно для правильного ведения документации и при необходимости воспроизведения процедур впоследствии (audit trail).
Вопрос-ответ
Какие бывают виды ослепления рандомизированных исследований?
Открытое рандомизированное исследование - и пациент, и врач сразу после проведения рандомизации узнают о том, какой вид лечения будет применен. Этот вид исследований обычно используют в тех случаях, когда очень сложно или этически нецелесообразно создать полную имитацию исследуемого вмешательства (например сравнение консервативного лечения отека мозга с хирургической декомпрессией).
Простое слепое рандомизированное исследование - пациенту не сообщают о виде применяемого лечения, и этот момент оговаривается с пациентом заранее при получении у него информированного согласия на исследование. Врач узнает, какой вариант лечения получит больной, после процедуры рандомизации.
Двойное слепое рандомизированное исследование - ни врач, ни пациент не знают, какое из вмешательств будет использовано. В случаях, когда исследуемый препарат необходимо готовить к введению ex tempore на клинической базе (например, разводить некоторым количеством физиологического раствора), хотя бы один человек из команды исследователей (непосредственно занимающийся приготовлением раствора) будет точно знать, что именно получает пациент. Как правило, в таких случаях на клиническую базу делегируются два независимых монитора клинических исследований, один из которых проверяет документацию только «ослепленых» исследователей, а второй - только «неослепленных». Чрезвычайно важно понимать, что сохранение в тайне распределения больных по группам лечения принципиально для непредвзятой оценки и самим пациентом, и наблюдающим за ним «ослепленным» исследователем результатов лечения, поэтому «неослепленный» персонал ни при каких обстоятельствах не должен делиться имеющейся у него информацией со своими коллегами.
Тройное слепое рандомизированное исследование - о типе вмешательства в каждой из сравниваемых групп не знают ни пациент, ни врач, ни статистик, обрабатывающий результаты исследования . В ключевых исследованиях часто создается независимый комитет по оценке данных, который проводит промежуточные анализы эффективности и безопасности до полного укомплектования и закрытия базы данных. Конечно же, членам комитета важно получить уже расшифрованные данные, то есть знать, какое лечение получал каждый из пациентов. В случае тройного слепого исследования для подготовки отчетов комитету используется отдельный независимый «неослепленный» статистик или группа статистиков. n
Александр Александрук, Павел Бабич
|
Список литературы |
|
|
Выделяют фиксированную рандомизацию (простую, блоковую и стратифицированную), динамическое распределение (метод «несимметричной монеты» и адаптивную рандомизацию). При фиксированной рандомизации пациент распределяется в ту или иную группу на основании случайных чисел, полученных из специальных таблиц или сгенерированных с помощью компьютерной программы. Простая рандомизация предполагает равновероятное распределение испытуемых в группы. Так, в случае, если имеются две группы — основная и контрольная, то есть вероятность попадания в группу лечения равна вероятности попадания в группу контроля и равна 50%. В таком случае возможно возникновение на определенном этапе исследования существенной разницы в численности групп, дисбаланса групп по возрасту, полу, тяжести заболевания и другим признакам. Метод блоковой рандомизации помогает достичь большей сбалансированности между группами по численности испытуемых в каждый момент проведения исследования — рандомизационная последовательность в этом случае формируется из блоков заданной длины, внутри которых и проводится случайное распределение.
|
Рисунок. Пример рандомизационной последовательности при блоковой рандомизации.
Пример готовой рандомизационной последовательности при блоковой рандомизации 16 испытуемых (размер блока фиксирован) приведен на рисунке. «А» означает распределение в группу А, «Б» — в группу Б, длина блока 4, вероятность распределения в ту или иную группу в соответствии с протоколом равна 50%. В этом примере первый рандомизированный пациент будет распределен в группу А, второй и третий в группу Б и так далее до 16 пациента, который попадает в группу А. Исследователь не имеет доступа к рандомизационной последовательности и не знает, в какую группу попадет каждый следующий испытуемый.
Однако при блоковой рандомизации исследователь может спрогнозировать, в какую группу будет распределен следующий испытуемый (если известен размер блока, предыдущие распределения внутри блока, а одна из двух групп внутри блока полностью укомплектована) — например, очевидно, что пациенты 7 и 8 из рисунка будут распределены в группу А, если известно, что длина блока 4, а пациенты 5 и 6 были распределены в группу Б. С целью недопущения такой возможности можно использовать случайное определение размера блоков (с использованием генератора случайных чисел) или не раскрывать информацию о величине блока, если она фиксирована.
Хотя в протоколе клинического исследования описывается принцип рандомизации, вероятность попадания в ту или иную группу, используемый технический метод осуществления процедуры, протокол не должен содержать специфических деталей, позволяющих исследователю спрогнозировать результат рандомизации для определенного испытуемого (например, длину блоков при блоковой рандомизации). Это требование содержится в документе ICH E9.
При стратифицированной (послойной) рандомизации учитывается какой-либо один или несколько (обычно не больше двух) важных признаков, которые могут существенно повлиять на результаты лечения, а, следовательно, должны быть равномерно распределены между группами. Такими признаками могут быть пол, возраст, основной диагноз, основной препарат базовой (неисследуемой) терапии, тяжесть состояния при поступлении и т.д. Это делается для того, чтобы формируемые таким образом отдельные выборки (группы лечения) были репрезентативными по отношению к генеральной совокупности (всех испытуемых, включенных в клиническое исследование) по основным прогностическим факторам, другими словами, чтобы каждая группа лечения была максимально похожа по составу на общую популяцию испытуемых данного исследования.
Метод «несимметричной монеты» позволят достичь большего равновесия между группами по какому-либо одному показателю путем динамического изменения вероятности включения испытуемых в ту или иную группу в зависимости от текущего баланса групп по заданному показателю. Так, для достижения текущего баланса групп по количеству испытуемых применяется следующий алгоритм: при включении испытуемого в исследование вероятность отнесения его к группе с меньшим количеством участников будет больше 50% (как правило, используется вероятность 66,6%), а если численность групп на определенном этапе равна, то вероятность распределения в одну их двух групп для следующего испытуемого составляет 50%.
Методы адаптивной рандомизации применяют при адаптивном дизайне клинических исследований, в которых распределение испытуемых в группы проводится таким образом, чтобы к концу исследования наибольшее количество испытуемых получило наиболее эффективный (или наиболее безопасный) препарат или дозу исследуемого препарата.
В таких случаях вероятность распределения пациентов в ту или иную группу лечения динамически изменяется на основании результатов промежуточных анализов данных. Существует много методов отклик-адаптивной рандомизации — например метод «игра на победителя» (Randomized-Play-the-Winner), пользосмещенная модель (Utility-Offset Model), модель максимальной полезности (Maximum Utility Model).
Преимуществом метода «игра на победителя» является то, что большему количеству пациентов будет назначено более эффективное лечение. К числу недостатков этого метода относится сложность расчета размера выборки; необходимость того, чтобы исходы для каждого предыдущего испытуемого были определены до момента включения следующего испытуемого в исследование; периодическое или постоянное раскрытие данных при слепых клинических испытаниях. Для борьбы с этими недостатками применяют автоматизацию процесса отнесения пациентов в группы путем разработки программного обеспечения и поэтапное проведение исследования.
При использовании в качестве метода адаптивной рандомизации пользосмещенной модели вероятность распределения пациента в ту или иную группу вычисляется на основании частоты положительного отклика на каждый из вариантов лечения и доли испытуемых, уже распределенных в эту группу.
В случае осуществления адаптивной рандомизации с помощью модели максимальной полезности следующий пациент всегда распределяется в ту группу, в которой наблюдается (или на основании модели предполагается) более высокая эффективность лечения.
Однако существуют определенные трудности и особенности применения методов адаптивной рандомизации. При слепом дизайне необходимо, например, обеспечить периодическое или постоянное раскрытие данных (часто для этого привлекается отдельная группа «неослепленных» статистиков); скорость анализа данных зависит от скорости их поступления, поэтому рандомизация следующего пациента может происходить до учета реакции предыдущего испытуемого и т.д.
Рандомизированные контролируемые клинические испытания (РКИ), проводятся в стационарах, реже в других ЛПУ с целью оценки потенциальной эффективности средств, способов и схем лечения, диагностики, болезней.
При оценке потенциальной эффективности препарата, предлагаемого для лечения какой либо болезни, популяцией являются больные с одинаковым клиническим течением этой болезни, сравнительно одинакового пола и возраста и другими признаками, которые могут влиять на исход болезни.
Выборка формируется с учетом определенных ограничений, при этом больные, представляющие популяцию, не попадают в выборку в основном по следующим причинам:
не соответствие критериям отбора по факторам, которые могут повлиять на предполагаемый эффект экспериментального лечения;
отказ участвовать в эксперименте;
предполагаемая возможность несоблюдения отдельными лицами условий эксперимента (например, нерегулярный прием назначенного препарата, нарушение правил обращаемости и т.д.);
противопоказания к экспериментальному лечению.
В результате такого отбора сформированная выборка может оказаться малочисленной, что скажется на результатах оценки достоверности различий частоты исходов в опытной и контрольной группе. Кроме того, сформированная выборка может быть резко смещена и даже достоверные данные будут иметь существенные ограничения при распространении результатов на всю популяцию больных.
Рандомизация в РКИ должна обеспечить сопоставимость групп по различным признакам и, главное, по признакам, влияющим на исход болезни . Однако этого можно достичь только при достаточно больших выборках, сформировать которые не всегда возможно. При малом числе больных, сопоставимость групп, как правило, нарушается в результате того, что часть лиц, по различным причинам, выбывает из эксперимента, что может препятствовать получению достоверных выводов.
Рис. 7. Рандомизированное контролируемое испытание для оценки результатов ранней выписки из больницы пациентов перенесших инфаркт миокарда.Источник. Основы эпидемиологии. Р Биглхол с соавт. ВОЗ, Женева, 1994.
Приведенные данные (рис. 7) показывают, как по разным причинам резко сократилось число пациентов участвующих в эксперименте. В итоге результаты статистической обработки оказались не достоверны, и по данным этого исследования только весьма ориентировочно можно полагать, что ранняя выписка (через 3 дня) безопасна для лиц перенесших инфаркт миокарда.
По снижению надежности методы рандомизации, применяемые в РКИ, чаще всего распределяют в следующем порядке:
централизованная рандомизация по телефону независимым специалистом статистиком, или представителем фармацевтической фирмы.
метод закодированных (пронумерованных) одинаковых контейнеров, поставляемых фармацевтической фирмой, при этом код и содержание контейнеров неизвестны ни больным, ни врачам, участвующим в исследовании;
централизованный компьютерный метод - компьютерная программа генерирует случайную последовательность распределения пациентов по группам, подобную последовательности в таблице случайных чисел, при этом разделение больных на группы сравнения проводится специалистом, участвующим только в процессе рандомизации.
метод непрозрачных, запечатанных и пронумерованных конвертов. Указания о необходимом вмешательстве помещаются в конверты, последовательно пронумерованные согласно таблице случайных чисел. Крайне важно, чтобы конверты вскрывали только после того, как в приемном отделении исследователь запишет на них фамилию больного и другие необходимые данные;
Независимо от метода, рандомизация может быть простой и стратифицированной (существуют и другие, реже используемые виды рандомизации). В случае простой рандомизации дополнительные факторы не учитываются, а каждый пациент имеет шанс 50 на 50 попасть в ту или иную группу. Стратифицированная рандомизация (выделение подгрупп – страт), применяется в случаях, когда невозможно создать группы с одинаковым прогнозом исхода опыта у испытуемых лиц. Например, если на результат исследования может повлиять один из заданных параметров (возраст, уровень артериального давления, перенесенный инфаркт миокарда и др.) пациентов вначале делят на подгруппы. Далее в каждой подгруппе группе проводят рандомизацию. Некоторые специалисты считают стратифицированную рандомизацию недостаточно корректной.
Несмотря на исключительную важность информации о методе рандомизации для оценки читателем надежности результатов исследования, разные авторы приводят практически одинаковые оценки исследований по этому параметру. Установлено, что в 80 - 90-х годах только в 25 - 35% отчетов об РКИ, опубликованных в специализированных журналах, и в 40 - 50% отчетов, опубликованных в общемедицинских журналах, сообщалось о применении правильного метода генерации случайной последовательности включения участников в группы. Почти во всех этих случаях использовались либо компьютерный генератор, либо таблица случайных чисел. При анализе статей, опубликованных в одном из журналов по дерматологии за 22 года, было установлено, что о применении правильного метода генерации случайной последовательности сообщалось лишь в 1 из 68 отчетов об РКИ.
Важнейший элемент организации РКИ средств лечения - использование метода ослепления (маскирования). Как указывалось в предыдущем разделе, предпочтение отдается двойному и даже тройному слепому исследованию, поскольку больные или медицинский персонал, участвующий в испытании, невольно или преднамеренно, могут исказить данные и повлиять тем самым на результат исследования.
Маскирование вмешательств от больных важно, потому что исход применяемого воздействия в значительной степени зависит от психологического состояния пациента. При открытости информации больные опытной группы могут либо неоправданно надеяться на благоприятный исход лечения, либо наоборот переживать по поводу того, что согласились быть «подопытными кроликами». Больные контрольной группы также могут вести себя по-разному, например, чувствовать себя обделенными, особенно если они будут считать, что в опытной группе процесс лечения более успешен. Разное психологическое состояние больных может привести к целеноправленным поискам ими признаков улучшения или наоборот ухудшения состояния их здоровья, что неминуемо скажется на собственной оценке состояния, изменения которого нередко оказываются мнимыми. Маскирование от врача-исследователя необходимо, так как он может быть заведомо убежден в преимуществах испытуемого средства и субъективно трактовать изменения состояния здоровья испытуемых.
Необходимость двойного маскирования объективно подтверждает «эффект плацебо». Плацебо – лекарственная форма, неотличимая от исследуемого препарата по внешнему виду, цвету, вкусу и запаху, но не оказывающая специфического действия, или иное безразличное вмешательство, используемое в медицинских исследованиях для имитации лечения с целью устранения систематической ошибки, связанной с плацебо-эффектом. Плацебо-эффект – изменение состояния пациента (отмечаемое самим пациентом или лечащим врачом), связанное только с фактом лечения, а не с биологическим действием препарата.
Многочисленными исследованиями установлено, что некоторые больные (в зависимости от болезни до 1/3) принимая плацебо за лекарство, реагируют на него так же, или почти так же, как и больные опытной группы. Изучение эффекта плацебо позволяет выделить специфические составляющие нового лечения. Кроме того, если больные не знают, к какой группе они относятся, они более точно следуют правилам эксперимента.
Как упоминалась в предыдущем разделе, для повышения надежности выводов вводят третье ослепление на этапе статистической обработки данных, поручая эти действия независимым лицам.
«Слепые» клинические исследования не используются при оценке потенциальной эффективности хирургических вмешательств, методов физиотерапии, диет, многих диагностических процедур и т.д., т.е. в тех случаях, когда замаскировать воздействие невозможно, или нецелесообразно ни для больных, ни для врачей. В таких случаях рандомизированные исследования называют открытыми.
По истечении установленного времени наблюдения проводят статистическую обработку выявленных исходов (эффектов воздействия) болезни в опытной и контрольной группе. Для того чтобы избежать систематическую ошибку, критерии исхода болезни в опытной и контрольной группах больных должны быть специфичны и одинаковы. Для повышения надежности выводов исследование нередко проводят не одномоментно, а в течение некоторого периода, включая в него вновь поступающих больных.
Для статистической обработки полученных данных применяется все та же таблица «два на два».

Таблица 11. Макет таблицы «два на два» для оценки результатов экспериментальных исследований.
Большинство показателей, оценивающих эффективность экспериментального воздействия в клинических и полевых испытаниях, хотя и имеют другие названия (так исторически сложилось), соответствуют и по способу расчета и по смыслу величинам, рассчитываемым в когортных исследованиях.
Для количественного выражения эффективности используют различные статистические показатели, при этом отсутствует строгая унификация их названий.
1.
Показатель
относительной эффективности (
показатель
эффективности
):

Эта величина соответствует относительному риску, вычисляемому в когортных исследованиях . Показатель эффективности определяет во сколько раз , частота позитивных исходов воздействия в опытной группе выше, чем их частота в контрольной группе, т.е. во сколько раз новый способ лечения, диагностики и др., лучше, чем обычно используемый.
Для интерпретации показателя эффективности используются оценочные критерии относительного риска (см. статистическую обработку данных когортного исследования). При этом, соответственно, изменяется смысл формулировок, так как оценивается не фактор риска болезни, а эффективность применяемого экспериментального воздействия.
2. Атрибутивный (добавочный) эффект , соответствует атрибутивному (добавочному) риску, определяемому в когортных исследованиях.

Величина атрибутивного эффекта показывает на сколько эффект от экспериментального воздействия больше, чем эффект от воздействия в контрольной группе;
3 . Доля эффекта воздействия (доля эффективности ) соответствует этиологической доле вычисляемой при анализе данных когортных исследований.

Эта величина показывает долю позитивных исходов, принадлежащую экспериментальному воздействию, в сумме позитивных эффектов в опытной группе.
4. дополнительная величина, которую назвали - число больных, которых необходимо лечить (ЧБНЛ) для предотвращения одного неблагоприятного исхода.

Чем больше этот показатель, тем меньше потенциальная эффективность изучаемого воздействия.
Так же, как и при обработке данных когортных исследований, достоверность полученных данных в экспериментах оценивается с помощью критерия «хи-квадрат» или другими методами.
В заключение отметим, что, несмотря на все достоинства, рандомизированные клинические испытания таят в себе возможность систематической ошибки, особенно ошибки связанной с формированием выборки. Следовательно, результаты одного исследования, даже безупречного по организации, не могут рассматриваться как безусловная рекомендация применения нового препарата в клинической практике. Именно поэтому в настоящее время надежными считаются только результаты многоцентровых исследованиий эффективности одного и того же вмешательства (лечения) несколькими клиниками, при этом желательно, чтобы исследования проводились в клиниках разных странах.
4
1 ГБОУ ВПО «Ивановский государственный университет»
2 ФГАОУ ВПО «Московский физико-технический институт (государственный университет)" г. Долго- прудный Московской области
3 ГБОУ ВПО «Ивановская ГМА» МЗ РФ
4 ФГБОУ ВО «Ивановская государственная медицинская академия» МЗ РФ
Для цитирования:
Егорова Е.Ю., Юргель И.С., Назаренко О.А., Философова М.С., Альпер И.А., Торшин И.Ю., Юдина Н.В., Гришина Т.Р., Громова О.А. Рандомизированное контролируемое исследование эффективности препарата Прогепар у пациентов с хроническим алкогольным гепатитом // РМЖ. 2011. №12. С. 753
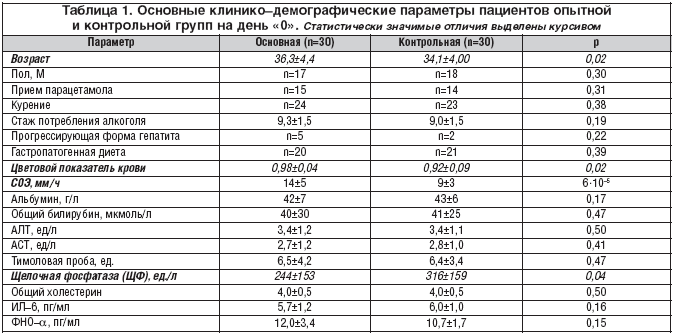
Введение Гепатопротекторы различаются по механизмам и спектру своего фармакологического воздействия. В 2008 году, в России в группе гепатопротекторных средств (КодАТХ: А05ВА) зарегистрирован препарат «Прогепар». В Германии и Японии этот препарат известен, как «Proheparum S.» От ранее известного препарата «Prohepar» отличается наличием особых синергидных компонентов (что и обозначает литера «S» в названии препарата).







Литература
1. Громова О.А., Торшин И.Ю., Юргель И.С. с соавт. Механизмы действия и клиническая эффективность комбинированного гепатопротекторного препарата Прогепар. Трудный Пациент, 2009, №12.
2. Баяши А.О., Акиома Х., Тацаки Х. Воздействие гидролизата печени на циркуляцию крови при хронических заболеваниях печени //Арцнаймиттель Форшунг, - 1972, 22С.578-580.
3. Fujisawa K., Suzuki H., Yamamoto S., Hirayama C., Shikata T., Sanbe R. Therapeutic effects of liver hydrolyzate Prohepar in chronic hepatitis - A double-blind controlled study. Asian Med. J. 26(8):497-526
4. Демидов В.И., Назаренко О.А., Егорова Е.Ю. с соавт. Исследование эффективности Прогепара при экспериментальном повреждении печени алкоголем и парацетамолом: биохимия и гистология. Фарматека, 2011, № 2.
5. Егорова Е.Ю., Философова М.С., Торшин И.Ю. с соавт. Сравнительная динамика персистирующей и прогрессирующей форм алкогольного гепатита в курсе терапии препаратом Прогепар. Российский Медицинский Журнал, Российский Медицинский Журнал, Том 19, № 2, 2011.
6. Федеральный закон от 12.04.2010 N 61-ФЗ «Об обращении лекарственных средств» www.government.ru .
7. Ивашкин В.Т., Маевская М.В. Алкогольно-вирусные заболевания печени. - М.: Литтерра, 2007. - 160 с.
8. Громова О. А., Сатарина Т. Е., Калачева А. Г., Лиманова О. А. Структурированный вопросник по оценке дефицита витаминов. Рационализаторское предложение № 2461 от 17 ноября 2008 г.
9. Журавлев Ю. И. Избранные научные труды. - М.: Магистр, 1998. - 420 с.
10. Журавлев Ю.И. Об алгебраическом подходе к решению задач распознавания или классификации//Проблемы кибернетики: Вып.33.. - 1978. - с. 5-68.
11. Тогузов Р.Т., Шачнев Е.А., Назаренко О.А. с соавт. Содержание фолатов и липоевой кислоты в гепатопротекторе прогепар, Фарматека, 2011, 3
12. Ребров В.Г., Громова О.А. Витамины, макро- и микроэлементы. ГэотарМед, М., - 2008, 946 с.
13. Торшин И.Ю., Громова О.А. Физиологическая модель взаимосвязи витамина D3 с онкологическими заболеваниями и данные доказательной медицины, Трудный пациент, 2008, №11, С. 21-26
14. Isoda K, Kagaya N, Akamatsu S, Hayashi S, Tamesada M, Watanabe A, Kobayashi M, Tagawa Y, Kondoh M, Kawase M, Yagi K. Hepatoprotective effect of vitamin B12 on dimethylnitrosamine-induced liver injury. Biol Pharm Bull. 2008 Feb;31(2):309-11.
Противоопухолевых препаратов различаются, каждое из них проводится для конкретно поставленных целей и подбирается под необходимые параметры для исследования препарата. На настоящий момент выделяют следующие виды клинических исследований:
Открытое и слепое клиническое исследование
Клиническое исследование может быть открытым и слепым. Открытое исследование - это когда и врач, и его пациент знают, какой препарат исследуется. Слепое исследование делится на простое слепое, двойное слепое исследование и полное слепое исследование.
- Простое слепое исследование - это когда одна сторона не знает, какой препарат исследуется.
- Двойное слепое исследование и полное слепое исследование - это когда две или более стороны не обладают информацией относительно исследуемого препарата.
Пилотное клиническое исследование проводится для получения предварительных данных, важных для планирования дальнейших этапов исследования. На простом языке можно было бы назвать его «пристрелочным». С помощью пилотного исследования определяется возможность проведения исследования на большем числе испытуемых, рассчитываются необходимые мощности и финансовые затраты для будущего исследования.
Контролируемое клиническое исследование - это сравнительное исследование, в котором новый (исследуемый) препарат, эффективность и безопасность которого еще до конца не изучены, сравнивают со стандартным способом лечения, то есть препаратом, уже прошедшим исследования и вышедшим на рынок.
Пациенты в первой группе получают терапию исследуемым препаратом, пациенты во второй – стандартным (эта группа называется контрольной , отсюда название вида исследования). Препаратом сравнения может быть как стандартная терапия, так и плацебо.
Неконтролируемое клиническое исследование - это исследование, в котором нет группы испытуемых, принимающих препарат сравнения. Обычно такой вид клинических исследований проводится для препаратов с уже доказанной эффективностью и безопасностью.
Рандомизированное клиническое исследование - это исследование, в котором пациенты распределяются на несколько групп (по видам лечения или схеме приема препарата) случайным образом и имеют одинаковую возможность получить исследуемый или контрольный препарат (препарат сравнения или плацебо). В нерандомизированном исследовании процедура рандомизации не проводится, соответственно пациенты не разделяются по отдельным группам.
Параллельные и перекрестные клинические исследования
Параллельные клинические исследования - это исследования, при которых испытуемые в различных группах получают либо только изучаемое лекарственное средство, либо только препарат сравнения. В параллельном исследовании сравниваются несколько групп испытуемых, одна из которых получает исследуемый препарат, а другая группа является контрольной. В некоторых параллельных исследованиях сравнивают различные виды лечения, без включения контрольной группы.
Перерекрестные клинические исследования – это исследования, в которых каждый пациент получает оба сравниваемых препарата, в случайной последовательности.
Проспективное и ретроспективное клиническое исследование
Проспективное клиническое исследование – это наблюдение за группой больных в течение длительного времени, до наступления исхода (клинически значимого события, которое служит объектом интереса исследователя – ремиссия, ответ на лечение, возникновение рецидива, летальный исход). Такое исследование является самым достоверным и поэтому проводится чаще всего, причем в разных странах одновременно, другими словами, оно является интернациональным.
В отличие от проспективного исследования, в ретроспективном клиническом исследовании , напротив, изучаются исходы проведенных ранее клинических исследований, т.е. исходы наступают до того, как началось исследование.
Одноцентровое и многоцентровое клиническое исследование
Если клиническое исследование проходит на базе одного исследовательского центра, оно называется одноцентровым , а если на базе нескольких, то многоцентровым . Если же, исследование проводится в нескольких странах (как правило, центры расположены в разных странах), его называют международным .
Когортное клиническое исследование – это исследование, в котором выделенную группу (когорту) участников наблюдают в течение какого-то времени. По окончании этого времени результаты исследования сравниваются у испытуемых в разных подгруппах данной когорты. На основании этих результатов делается вывод.
В проспективном когортном клиническом исследовании группы испытуемых составляют в настоящем времени, а наблюдают в будущем. В ретроспективном когортном клиническом исследовании группы испытуемых подбирают на основании архивных данных и прослеживают их результаты по настоящее время.

Какой вид клинического исследования будет наиболее достоверным?
В последнее время, фармацевтические фирмы обязывают проводить клинические исследования, при которых получаются самые достоверные данные . Чаще всего удовлетворяет таким требованиям проспективное двойное слепое рандомизированное многоцентровое плацебо-контролируемое исследование . Это значит, что:
- Проспективное – будет вестись наблюдение в течение длительного времени;
- Рандомизированное – пациентов случайно распределили по группам (обычно это делает специальная компьютерная программа, чтобы в итоге различия между группами стали несущественными, то есть статистически недостоверными);
- Двойное слепое - ни врач, ни пациент не знает, в какую группу пациент попал при рандомизации, поэтому такое исследование максимально объективно;
- Многоцентровое – выполняется сразу в нескольких учреждениях. Некоторые виды опухолей чрезвычайно редки (например, наличие ALK-мутации при немелкоклеточном раке легкого), поэтому в одном центре сложно найти необходимое количество пациентов, соответствующих критериям включения в протокол. Поэтому такие клинические исследования проводятся сразу в нескольких исследовательских центрах, причем как правило, в нескольких странах одновременно и называются международными;
- Плацебо-контролируемое – участники делятся на две группы, одни получают исследуемый препарат, другие – плацебо;
