Синтез мочевины - это главный путь обезвреживания аммиака в оранизме. Мочевина - конечный азотистый продукт, выделяющийся с мочой у человека и млекопитающих. Образование ее происходит в печени. В 1932 г. возникла теория синтеза мочевины, известная под названием цикла Кребса, согласно которой в синтезе мочевины принимают участие 3 аминокислоты - аргинин, орнитин и цитрулин. Причем образование мочевины по циклу Кребса происходит в срезах печени в аэробных условиях. Схематически образование мочевины по циклу Кребса можно представить следующим образом:
Суммирование реакций цикла образования мочевины приводит к следующему уравнению:
Образование мочевины по указанному циклу получило свое подтверждение и является общепринятым. Однако в последствии цикл Кребса подвергся существенной детализации. Из приведенных выше реакций можно видеть, что в образовании мочевины участвуют свободный аммиак и углекислый газ. Между тем известно, что аммиак, по мере своего образования в тканях, устраняется с образованием глутамина. Далее известно, что реакции переаминирования, которые активно происходят в различных тканях, приводят к тому, что аминогруппы подвергающихся распаду аминокислот не освобождаются в виде аммиака, а переносятся на кетокислоты. Естественно возникает вопрос, откуда же в печени берется аммиак, необходимый для синтеза мочевины? Ответ на этот вопрос дают проведенные Ратнер с сотр. исследования, показывающие, что в синтезе мочевины помимо свободного аммиака участвуют аминогруппы, входящие в состав аминокислот, в частности аспарагиновой, без предварительного отщепления их в виде аммиака. Таким образом, последовательность синтеза мочевины можно представить следующими реакциями:
1) Аммиак взаимодействует с углекислым газом под действием
фермента карбамоилфосфатсинтетазы, образуется карбамоилфосфат
2) Карбамоилфосфат взаимодействует с орнитином, образуется
цитруллин и фосфат (катализатор - орнитин - карбамоилфосфат-
трансфераза)

3) Цитруллин взаимодействует с аспарагиновой кислотой с
образованием аргининсукцината:

Катализирует реакцию аргининсукцинатсинтетаза.
4) Аргининсукцинат расщепляется аргининсукцинатлиазой на фумарат
и аргинин:

5) Аргинин под действием аргиназы расщепляется гидролитически на
мочевину и орнитин:

 |
Из приведенных реакций можно заключить, что одна группа NH 2 молекулы мочевины образуется из аммиака, а другая из аминогруппы аспарагиновой кислоты. Отсюда следует вывод, что аминогруппы 50% аминокислот, подвергающихся в организме превращению путем переаминироваиия (через глутаминовую кислоту), включаются в шавелевоуксусную кислоту с образованием аспарагиновой кислоты. Аминогруппа аспарагиновой кислоты, как мы видели, непосредственно используется для синтеза мочевины. Использование азота аминокислот (аминогрупп) для синтеза мочевины видно из схемы, показывающей связь между синтезом мочевины и циклом трикарбоновых кислот.
Обезвреживание аммиака в тканях может происходить и путем синтеза глутамина и аспарагина. Однако большая часть NH 3 утилизируется за счет синтеза мочевины.
Обмен сложных белков
ОБМЕН НУКЛЕОПРОТЕИДОВ
В ЖКТ под действием соляной кислоты, пепсина, трипсина и др. ферментов от нуклеопротендов отщепляется белковая часть и гидролизуется до аминокислот. Простетическая группа - нуклеиновые кислоты - разрушаются до мононуклеотидов под действием нуклеаз. Мононуклеотнды частично всасываются, а большей частью под действием фосфатаз и нуклеотидаз расщепляются на составные компоненты: азотистые основания, пентозы и фосфорную кислоту, которые, как водорастворимые вещества, активно всасываются. Фосфорная кислота пополняет запасы фосфора в организме, пентозы принимают участие в процессах окисления и синтеза новых НК, а азотистые основания
подвергаются различным превращениям. Так пуриновые азотистые основания после дезаминирования превращаются в ксантин, а затем под действием ксантиноксидазы - в мочевую кислоту, которая выводится из организма почками.
Конечными продуктами распада пиримидиновых азотистых
оснований являются аммиак, CO 2 и простые азотистые соединения. Так
урацил распадается на NH 3 , СО 2 и b- аланин. Пути превращения NH 3 и CО 2
мы же рассматривали, а b-аланин участвует в синтезе КоА.
Одновременно с распадом в клетках осуществляется постоянный синтез нуклеиновых кислот. Это сложный процесс, в котором участвует большое число исходных соединений: пентозы, глицин, глутамин, аспарагиновая кислота, активная форма СО 2, АТФ и соответствующие ферменты. В ходе синтеза образуются сначала мононуклеотиды: АМФ, ГМФ, УМФ, последнее соединение служит стартовым веществом для образования ТМФ и ЦМФ.
Для синтеза самих НК необходимы все типы нуклеотидтрифосфатов, набор ферментов и ДНК, на матрице которой строятся новые дочерние молекулы ДНК и молекулы РНК.
ОБМЕН ХРОМОПРОТЕИДОВ.
Из многих представителей хромопротеидов для человека наибольшее значение имеет гемоглобин, обмен которого мы и рассмотрим.

Поступающий с пищей гемоглобин (НЬ) в ЖКТ распадается на свои составные части - гем и глобин. Глобин гидролизуется до аминокислот, которые всасываются в кровь, а гем окисляется до гематина и выводится с калом, т.е. экзогенный гем не используется.
Обмен эндогенного Hb протекает весьма интенсивно и связан с периодом существования эритроцитов, в которых содержится весь НЬ. Этот период составляет 110 -120 дней, после чего эритроциты распадаются, процесс активно протекает в печени, селезенке, костном мозге и др. тканях РЭС. Часть же эритроцитов распадаегся в кровеносном русле, освободившийся при этом НЬ адсорбируется в крови гаптоглобином и транспортируется в печень, где распадается по вышеуказанной схеме.
В клетках РЭС НЬ вначале окисляется под действием гем-оксигеназы до вердоглобина (зеленого цвета). Последний спонтанно (самопроизвольно) распадается на свои составные части: глобин, Fe 3+ и оставшуюся часть гема-биливердин (пигмент зеленого цвета). Глобин гидролизуется до аминокислот. Fe 3+ захватывается трансферрином и кровью доставляется в печень, где освобождается от белка-переносчика и откладывается про запас в виде ферритина (соединение Fe с особым белком). Этот комплекс по мере надобности распадается, Fe вновь адсорбируется трансферрином, доставляется в клетки, где участвует в синтезе НЬ, цитохромов и пр.
Биливердин восстанавливается в билирубин - пигмент желто-красного цвета, который является водонерастворимым и весьма токсичным веществом. Поэтому он быстро выводится из клеток РЭС, поступает в кровь, где адсорбируется альбумином, образуя растворимый в воде и нетоксичный комплекс, называемый свободным билирубином (непрямым) . Он транспортируется в печень, где распадается и билирубин попадает в гепатоциты. Здесь он взаимодействует с активной формой глюкуроновой кислоты (УДФКГ) с образованием моно- и диглюкуронидбилирубина, являющегося нетоксичным иводорастворимым соединением, называемым связанным билирубином (прямым ). Связанный билирубин поступает в желчный пузырь, входит в состав желчных пигментов, выделяется с желчью в кишечник, где от него отщепляется глюкуроновая кислота. Освободившийся билирубин подвергается воздействию ферментов микроорганизмов с образованием мезобилиногена, а затем – стсркобилиногена, который окисляетсякислородом воздухадо стеркобилина и выводится с калом. Небольшая часть мезобилиногена всасывается в кровь и по воротной вене доставляется в печень, где расщепляется до диперролов (2 пиррольных кольца), которые задерживаются печенью ине поступают в общий кровоток. Большая же часть мезобилиногена, превратившаяся в стеркобилиноген, в нижних отделах толстой кишки всасывается в кровь и через геморроидальные вены попадает в систему большого круга кровообращения, а затем выводится с мочой в виде уробилиногена, окисляющегося на воздухе в уробилин.
Таков в обших чертах основной путь распада НЬ.
Но для нормальной жизнедеятельности организма постоянно требуется определенное количество НЬ, синтез которого осуществляется по следующей схеме.

Чтобы организм человека поддерживал нормальную жизнедеятельность, он выработал механизмы выведения токсических веществ. Среди них аммиак - конечный продукт метаболизма азотистых соединений, прежде всего белков. NH 3 токсичен для организма, и, как любой яд, выводится через выделительную систему. Но прежде аммиак претерпевает целый ряд последовательных реакций, который носит название орнитиновый цикл.
Типы азотистого обмена
Не для всех животных характерно выделение аммиака в окружающую среду. Альтернативными конечными веществами метаболизма азота являются и мочевина. Соответственно, называют три типа азотистого обмена, в зависимости от выделяемого вещества.
Аммониотелический тип. Конечным веществом здесь является бесцветный газ, растворимый в воде. Аммониотелия характерна для всех рыб, которые обитают в соленых водоемах.
Уреотелический тип. Животные, для которых характерна уреотелия, выделяют в окружающую среду мочевину. Примерами являются пресноводные рыбы, амфибии и млекопитающие, в том числе и человек.
Урикотелический тип. Сюда относятся те представители животного мира, у которых конечным метаболитом являются кристаллы мочевой кислоты. Это вещество как продукт азотистого обмена встречается у птиц и пресмыкающихся.
В любом из этих случаев задача конечного продукта обмена - это выведение ненужного азота из организма. Если этого не происходит, наблюдается таксация клеток и ингибирование важных реакций.
Мочевина - это амид Она образуется из аммиака, углекислого газа, азота и аминогрупп некоторых веществ во время протекания реакций орнитинового цикла. Мочевина - это продукт выделения уреотелических животных, среди которых и человек.
Мочевина является одним из способов экскреции избытка азота из организма. Образование этого вещества несет протекторную функцию, т.к. предшественник мочевины - аммиак, токсичен для клеток человека.
При переработке 100 г белка различной природы с мочой выделяется 20-25 г мочевины. Вещество синтезируется в печени, а после с током крови попадает в нефрон почки и выводится вместе с мочой.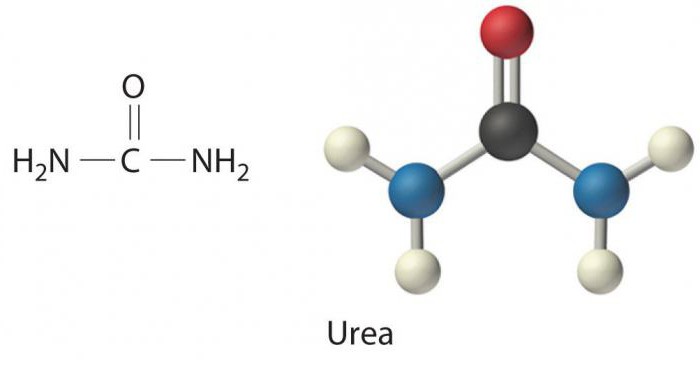
Печень - главный орган синтеза мочевины
Во всем организме человека не найдется такой клетки, в которой будут присутствовать абсолютно все ферменты орнитинового цикла. Кроме гепатоцитов, конечно. Функция клеток печени состоит не только в синтезе и разрушении гемоглобина, но и в проведении всех реакций синтеза мочевины.
Под описание орнитинового цикла подходит тот факт, что он является единственным способом удаления азота из организма. Если на практике ингибировать синтез или действие главных ферментов, синтез мочевины остановится, а организм погибнет от переизбытка аммиака в крови.
Орнитиновый цикл. Биохимия реакций
Цикл синтеза мочевины проходит в несколько этапов. Общая схема орнитинового цикла представлена ниже (картинка), поэтому разберем каждую реакцию в отдельности. Первые две стадии протекают непосредственно в митохондриях клеток печени.
NH 3 реагирует с углекислым газом с затратой двух молекул АТФ. В результате этой энергозатратной реакции образуется карбамоилфосфат, в котором содержится макроэргическая связь. Катализирует этот процесс фермент карбамоилфосфат-синтетаза.
Карбамоилфосфат вступает в реакцию с орнитином под действием фермента орнитин-карбамоил-трансферазы. В итоге макроэргическая связь разрушается, а за счет ее энергии образуется цитруллин.
Третья и последующие стадии протекают не в митохондриях, а в цитоплазме гепатоцитов.
Идет реакция между цитруллином и аспаратом. С затратой 1 молекулы АТФ и под действием фермента аргинино-сукцинат-синтазы образуется аргинино-сукцинат.
Аргинино-сукцинат в совокупности с ферментом аргинино-сукцина-лиаза расщепляется до аргинина и фумарата.
Аргинин в присутствии воды и под действием аргиназы расщепляется до орнитина (1 реакция) и мочевины (конечный продукт). Цикл замкнулся.
Энергетика цикла синтеза мочевины
Орнитиновый цикл - энергозатратный процесс, при котором расходуются макроэргические связи молекул аденозинтрифосфата (АТФ). На протяжении всех 5 реакции в совокупности образуются 3 молекулы АДФ. К тому же энергия уходит на транспорт веществ из митохондрии в цитоплазму и наоборот. Откуда же берется АТФ?
Фумарат, который образовался в четвертой реакции, может быть использован как субстрат в цикле трикарбоновых кислот. В ходе синтеза малата из фумарата выделяется НАДФН, который дает в результате 3 молекулы АТФ.
Реакция дезаминирования глутамата также играет роль в снабжении клеток печени энергией. При этом выделяются также 3 молекулы АТФ, которые идут на синтез мочевины.
Регуляция активности орнитинового цикла
В норме каскад реакций синтеза мочевины функционирует на 60% от возможного значения. При повышенном содержании белка в пище происходит ускорение реакций, что приводит к повышению общего КПД. Метаболические нарушения орнитинового цикла наблюдаются при высоких физических нагрузках и длительном голодании, когда организм начинает расщеплять собственные белки.
Регулирование работы орнитинового цикла может происходить и на биохимическом уровне. Здесь мишенью является основной фермент карбамоилфосфат-синтетаза. Его аллостерическим активатором является N-ацетил-глутамат. При его большом содержании в организме реакции синтеза мочевины протекают нормально. При недостатке самого вещества или его предшественников, глутамата и ацетил-КоА, орнитиновый цикл теряет свою функциональную нагрузку.
Связь цикла синтеза мочевины и цикла Кребса
Реакции обоих процессов протекают в матриксе митохондрий. Это дает возможность участвовать некоторым органическим веществам в двух биохимических процессах.
СО 2 и аденозинтрифосфат, которые образуются в цикле лимонной кислоты, являются предшественниками карбамоилфосфата. АТФ также является важнейшим источником энергии.
Орнитиновый цикл, реакции которого протекают в гепатоцитах печени, - это источник фумарата, одного из важнейших субстратов в Более того, это вещество в результате нескольких поэтапных реакций дает начало аспартату, который, в свою очередь, используется в биосинтезе орнитинового цикла. Реакция с участием фумарата является источником НАДФ, с помощью которого можно фосфорилировать АДФ до АТФ.
Биологический смысл орнитинового цикла
Подавляющая часть азота поступает в организм в составе белков. В аминокислоты разрушаются, образуется аммиак как конечный продукт обменных процессов. Орнитиновый цикл - это несколько последовательных реакций, главная задача которых состоит в детоксикации NH 3 с помощью его перевода в мочевину. Мочевина, в свою очередь, поступает в нефрон почки и выводится из организма с мочой.
Кроме того, побочно орнитиновый цикл является источником аргинина - одной из незаменимых аминокислот.
Нарушения в синтезе мочевины может привести к такому заболеванию, как гипераммониемия. Эта патология характеризуется повышенной концентрацией ионов аммония NH 4 + в крови человека. Эти ионы отрицательно сказываются на жизнедеятельности организма, выключая или замедляя некоторые важные процессы. Игнорирование этого заболевания может привести к летальному исходу.
Основным механизмом обезвреживания аммиака в организме является биосинтез мочевины. Последняя выводится с мочой в качестве главного конечного продукта белкового, соответственно аминокислотного, обмена. На долю мочевины приходится до 80-85% от всего азота мочи. Основным и, возможно, единственным местом синтеза мочевины является печень. Впервые Г. Кребс и К. Гензеляйт в 1932 г. вывели уравнения реакций синтеза мочевины, которые представлены в виде цикла, получившего в литературе название орнитинового цикла мочевинообразования Кребса .
Следует указать, что в биохимии это была первая циклическая система метаболизма, описание которой почти на 5 лет опеределило открытие Г. Кребсом другого метаболического процесса - цикла трикарбоновых кислот. Дальнейшие исследования в основном подтвердили циклический характер биосинтеза мочевины в печени. Благодаря исследованиям Г. Коена, С. Ратнер и сотр. были уточнены промежуточные этапы и ферментные системы, катализирующие образование мочевины.
Таким образом, весь цикл мочевинообразования может быть представлен следующим образом. На первом этапе синтезируется макроэргическое соединение карбамоилфосфат - метаболически активная форма аммиака, используемая в качестве исходного продукта для синтеза пиримидиновых нуклеотидов (соответственно ДНК и РНК) и аргинина (соответственно белка и мочевины):
Мочевина - основной конечный продукт азотистого обмена, в составе которого из организма выводится избыток азота .
Орнитиновый цикл в печени выполняет две функции:
Превращение аминокислот в мочевину, которая экскретируется и предотвращает накопление токсичных продуктов, главным образом аммиака;
Синтез аргинина и пополнение его фонда в организме.
Рассмотрим цикл мочевины:
![]()
Рисунок 34 - Орнитиновый цикл синтеза мочевины в печени
Начинается он с образования карбамоилфосфата в митохондриях, где много АТФ.
1 Образование карбамоилфосфата . Ионы аммония, возникшие в результате окислительного дезаминирования глутаминовой кислоты, взаимодействуют с гидрокарбонат - анионом и АТФ при участии карбамоилфосфатсинтетазы, образуя карбамоилфосфат, содержащий макроэргическую связь:
NН 4 + + НСО 3 - + 2АТФ → Н 2 N - С + 2АДФ + Н 2 РО 4 - + Н +
Карбамоилфосфат
2. Получение цитруллина . В матриксе митохондрий карбамоилфосфат конденсируется с аминокислотой орнитином, которая, являясь гомологом лизина, не входит в состав белков.
Реакция катализируется орнитинкарбамоилтрансферазой :
Н СОО - О Н СОО -
С + Н 2 N - С → СО + Н 2 РО 4 -
+ / \ + \ + / \ ||
Н 3 N (СН 2) 3 NН 3 О ~ Ф Н 3 N (СН 2) 3 NН - С - NН 2
Орнитин Карбамоилфосфат цитруллин
Образующийся цитруллин переходит в цитозоль клеток печени, где и происходят остальные реакции цикла мочевины.
3. Получение аргининосукцината . Замещение карбонильной группы цитруллина на аминогруппу аспартата с образованием гуанидиновой группировки аргининосукцината происходит при участии АТФ и катализируется аргининосукцинатсинтетазой:
Н СОО - Н СОО -
С О + С + АТФ →
Н 3 N (СН 2) 3 NН - С - NН 2 Н 3 N СН 2 СОО -
Цитруллин аспартат
С Н 2 N СН 2 СОО - + Н 2 Р 2 О 7 2- + АМФ
Н 3 N (СН 2) 3 NН - С - NН - СНСОО -
Аргининосукцинат
Реакция эндэргоническая, на протекание первой и третьей реакций цикла расходуется 4 молекулы АТФ.
4. Распад аргининосукцината . Под действием аргининосукцинатлиазы аргининосукцинат экзэргонически расщепляется с образованием аргинина и фумарата:
Н СОО - Н СОО - СОО - Н
С Н 2 N СН 2 СОО - → С Н 2 N + С = С
+ / \ || | + / \ || / \
Н 3 N (СН 2) 3 NН - С - NН - СНСОО - Н 3 N (СН 2) 3 NН - С - NН 2 Н СОО -
Аргининосукцинат Аргинин Фумарат
5. Образование мочевины и регенерация орнитина. Гидролиз аргинина, катализируемый аргиназой, приводит к образованию мочевины и регенерации орнитина. Реакция экзэргонична.
Н СОО - Н СОО - NН 2
С Н 2 N → С + О = С
+ / \ || + / \ + \
Н 3 N (СН 2) 3 NН - С - NН 2 Н 3 N (СН 2) 3 NН 3 NН 2
Аргинин Орнитин Мочевина
Регенерированный орнитин может снова поступать в митохондрии и участвовать в новом обороте цикла мочевины. Образующуюся мочевину кровь переносит из печени в почки, где извлекается из крови и удаляется из организма с мочой.
В орнитиновом цикле расходуется 4 макроэргические связи трех молекул АТФ на каждый оборот цикла.
Однако процесс образования мочевины обеспечивает сам себя энергией:
При регенерации аспартата из фумарата на стадии дегидрирования малата образуется НАДН, который может обеспечить синтез 3 макроэргических связей.
При окислительном дезаминировании глутамата в разных органах тоже образуется НАДН, который может обеспечить синтез 3 макроэргических связей.
Из приведенных реакций видно, что токсичный аммиак превращается в безвредную мочевину. При этом один из атомов азота мочевины образуется из аммиака, другой - из аспартата.
24.4.1. Биосинтез мочевины - основной путь обезвреживания аммиака. Мочевина синтезируется в орнитиновом цикле, протекающем в клетках печени. Эту последовательность реакций открыли Х.Кребс и К.Хензелейт в 1932 г. Согласно современным представлениям, цикл мочевины включает последовательность пяти реакций.
Две начальные реакции биосинтеза мочевины происходят в митохондриях клеток печени.

Последующие реакции протекают в цитоплазме клеток печени.



Общая схема орнитинового цикла представлена на рисунке 24.2:

Рисунок 24.2.
Схема орнитинового цикла и его связь с превращениями фумаровой и аспарагиновой кислот.
Цифрами обозначены ферменты, катализирующие реакции орнитинового цикла: 1 - карбамоилфосфатсинтетаза; 2 - орнитин-карбамоилтрансфераза; 3 - аргининосукцинатсинтетаза; 4 - аргининосукцинатлиаза; 5 - аргиназа.
24.4.2. Орнитиновый цикл находится в тесной взаимосвязи с циклом трикарбоновых кислот :
- пусковые реакции цикла мочевины, как и реакции ЦТК, протекают в митохондриальном матриксе;
- поступление СО2 и АТФ, необходимых для образования мочевины, обеспечивается работой ЦТК;
- в цикле мочевины образуется фумарат, который является одним из субстратов ЦТК. Фумарат гидратируется в малат, который в свою очередь окисляется в оксалоацетат. Оксалоацетат может подвергаться трансаминированию в аспартат; эта аминокислота участвует в образовании аргининосукцината.
24.4.3. Регуляция активности ферментов цикла осуществляется главным образом на уровне карбамоилфосфатсинтетазы, которая малоактивна в отсутствие своего аллостерического активатора - N-ацетил-глутамата. Концентрация последнего зависит от концентрации его предшественников (ацетил-КоА и глутамата), а также аргинина, который является аллостерическим активатором N-ацетилглутаматсинтазы:
Ацетил-КоА + Глутамат N-ацетилглутамат + КоА-SH
Концентрация ферментов орнитинового цикла зависит от содержания белка в пищевом рационе. При переходе на диету, богатую белком, в печени повышается синтез ферментов орнитинового цикла. При возвращении к сбалансированному рациону концентрация ферментов снижается. В условиях голодания, когда усиливается распад тканевых белков и использование аминокислот как энергетических субстратов, возрастает продукция аммиака, концентрация ферментов орнитинового цикла увеличивается.
24.4.4. Нарушения орнитинового цикла . Известны метаболические нарушения, обусловленные частичным блокированием каждого из 5 ферментов, катализирующих в печени реакции синтеза мочевины, а также N-ацетилглутаматсинтазы. Эти генетические дефекты, очевидно, являются частичными. Полное блокирование какой-либо из стадий цикла мочевины в печени, по-видимому, несовместимо с жизнью, потому что другого эффективного пути удаления аммиака не существует.
Общим признаком всех нарушений синтеза мочевины является повышенное содержание NH4 + в крови (гипераммониемия ). Наиболее тяжёлые клинические проявления наблюдаются при дефекте фермента карбамоилфосфатсинтетазы. Клиническими симптомами, общими для всех нарушений цикла мочевины, являются рвота, нарушение координации движений, раздражительность, сонливость и умственная отсталость. Если заболевание не диагностируется, то быстро наступает гибель. У детей старшего возраста проявлениями заболевания служат повышенная возбудимость, увеличение размеров печени и отвращение к пище с высоким содержанием белка.
Лабораторная диагностика заболеваний включает определение содержания аммиака и метаболитов орнитинового цикла в крови, моче и спинномозговой жидкости; в сложных случаях прибегают к биопсии печени.
Значительное улучшение наблюдается при ограничении белка в диете, при этом могут быть предотвращены многие нарушения мозговой деятельности. Малобелковая диета приводит к снижению содержания аммиака в крови и к улучшению клинической картины при мягких формах этих наследственных нарушений. Пищу следует принимать часто, небольшими порциями, для того чтобы избежать резкого повышения уровня аммиака в крови.
24.4.5. Клинико-диагностическое значение определения мочевины в крови и моче. В крови здорового человека содержание мочевины составляет 3,33 - 8,32 ммоль/л. За сутки с мочой выводится 20 - 35 г мочевины.
Изменения содержания мочевины в крови при заболеваниях зависят от соотношения процессов её образования в печени и выведения почками. Повышение содержания мочевины в крови (гиперазотемия) отмечается при почечной недостаточности, снижение - при недостаточности печени, при диете с низким содержанием белков.
Повышение экскреции мочевины с мочой наблюдается при употреблении пищи с высоким содержанием белков, при заболеваниях, сопровождающихся усилением катаболизма белков в тканях, при приёме некоторых лекарств (например, салицилатов). Снижение экскреции мочевины с мочой характерно для заболеваний и токсических поражений печени, заболеваний почек, сопровождающихся нарушением их фильтрационной способности.
Аммиак образуется в результате дезаминирования аминокислот, амидов, аминов, а также нуклеотидов. Основным источником аммиака является окисление глутамата глутаматдегидрогеназы, что происходит практически во всех тканях организма.
Поскольку аммиак высокотоксичное вещество, особенно для нервной системы, в процессе эволюции в организме человека выработались в-скончались механизмы его обезвреживания. Уровень аммиака в крови в норме не превышает 50 мкмоль / л. Токсичность аммиака обусловлена рядом факторов. В тканях и жидкостях организма аммиак преимущественно находится в виде катиона аммония (NН 4 +), что плохо проникает через мембраны. Но в равновесии с NН4 + находится около 1% свободного аммиака, легко проходит через мембраны. В митохондриях аммиак взаимодействует с альфа-кетоглутаратом в обратной глутаматдегидрогеназний реакции, давая глутамат. Высокое содержание аммиака стимулирует отток альфа-кетоглутарата из цикла лимонной кислоты, а следовательно, снижение митохондриального окисления и синтеза АТФ, причем наиболее чувствительны клетки мозга, которые обеспечиваются энергией почти полностью за счет аэробной распада глюкозы.
Основными конечными продуктами метаболизма аммиака в животных и человека является мочевина, образование которой происходит в печени. Перенос аммиака от периферических тканей к печени и почек осуществляется в виде глутамина. Эта аминокислота образуется из глутаминовой кислоты путем присоединения аммиака под действием глутаминсинтетазы.
Глутамин является нейтральным нетоксичным соединением, которая, в отличие от глутамата, легко проходит через клеточные мембраны. В мозгу действие глутаминсинтетазы сочетается с действием глутаматдегидрогеназы, функционирующей преимущественно в направлении синтеза глутамата с альфа-кетоглутарата. С мозга глутамин свободно диффундирует в кровь или спинномозговую жидкость, устраняя при этом две молекулы токсичного аммиака.
Глутаминсинтетаза активная и в печени. Здесь она поддерживает внутриклеточную концентрацию аммиака на уровне, не достигает границ токсичности. В печени и почках глутамин под действием глутаминазы гидролизуется до глутамата и свободного аммиака. В транспорте аммиака из мышц в печень участвует нейтральная аминокислота – аланин. При интенсивной мышечной работе часть аминокислот путем глюконеогенеза превращается в глюкозу. В этих условиях в мышцах образуется значительное количество аммиака. Аммиак взаимодействует с альфа-кетоглутаратом, образуется глутамат. Последний взаимодействует с пирувата, содержание которого за счет усиления гликолиза во время работы повышается. Происходит реакция переаминирования между пирувата и глутаматом.
Аланин переносится с кровью в печень, где под действием аланинаминотрансферазы передает аминогруппу альфа-кетоглутарата, а дальше с глутамата в глутаматдегидрогеназний реакции освобождается аммиак. С пирувата в печени ресинтезуеться глюкоза, которая вновь днадходить в мышцы.
Циклический процесс синтеза мочевины открытый Г. Кребса и К. Хенселайтом в 1932 году. В цикле участвуют две аминокислоты, которые не входят в состав белков (орнитин и цитруллин), и две аминокислоты, содержащиеся в белках (аргинин и аспартат). Кребс и Хенселайт открыли, что скорость синтеза мочевины резко возрастает, когда в среду добавляют орнитин, аргинин или цитруллин. На основе этих фактов Кребс предложил схему синтеза мочевины. Цикл состоит из 5 реакций, каждая из которых катализируется отдельным ферментом.
Цикл образования мочевины и цикл лимонной кислоты тесно взаимосвязаны. Так, поступления СО2 и АТФ, необходимых для образования мочевины, обеспечивается работой цикла лимонной кислоты. Фумаровая кислота, которая образуется при расщеплении аргининосукцинату, с участием ферментов цикла лимонной кислоты превращается из малат в оксалоацетат, а последний в реакции трансаминирования с глутаматом снова дает аспартат. Непосредственными источниками атомов азота молекулы мочевины является аммиак и аспартат. Оба они могут быть получены из глутамата: аммиак – путем окислительного дезаминирования, аспартат – трансаминирования. А благодаря Трансаминирование с альфа-кетоглутаратом все аминокислоты способны отдать аминогруппы в мочевину, конечный продукт катаболизма аминокислот в организме человека.
